- 首页
- 产品
- 服务
- 现货
- 专题
- 学术
- 关于
上海赛瑞格生物科技有限公司,由一批优秀的中科院博士创建而成,为各类医疗研究机构和医药健康企业提供转化医学研究咨询和技术服务。
上海赛瑞格生物科技有限公司

染色质免疫沉淀测序(ChIP-seq)
发布时间: 2022-04-15
浏览量:2539
染色质免疫沉淀技术,Chromatin Immunoprecipitation,ChIP
染色质免疫沉淀技术(Chromatin Immunoprecipitation ,ChIP)是研究体内蛋白质与DNA相互作用的经典实验方法。将ChIP与第二代测序技术相结合的ChIP-seq 技术,可以在全基因组范围内对蛋白质结合DNA位点进行高效而准确的筛选与鉴定,广泛应用于组蛋白修饰、转录因子调控等相关领域的研究。通过五个步骤获得理想的ChIP-seq结果。
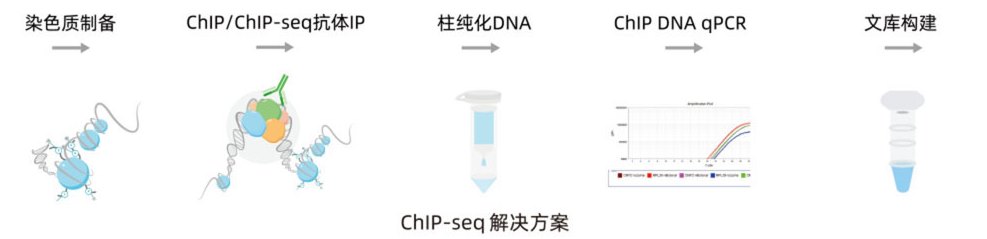
1. 染色质制备 交联和片段化。
交联是为了固定蛋白质-DNA相互作用,通常采用甲醛交联,加入甘氨酸终止反应,可以高温解交联。一些非常稳定的蛋白质-DNA相互作用则不需要交联,如组蛋白及修饰。使用裂解液破坏细胞膜,抽提细胞核,再裂解释放细胞核中的染色质,去除细胞质蛋白以减少背景信号并增加灵敏度。
染色质片段化是获得良好ChIP分辨率的关键因素,片段化是最难控制的步骤之一。可以通过超声或酶促消化实现片段化,各有利弊。超声需要较多的手动操作时间,适合难以裂解的样本;酶促消化适合大量样本的处理,但其片段化位点是随机的。需要根据具体样本选择不同的片段化方法。
注意:此时可以暂停ChIP实验,经过超声/酶消化的染色质样本可以保存于-80℃,避免反复冻融。
染色质制备注意事项:
- (1)交联不充分,会导致DNA丢失
- (2)交联过度,会影响抗原的结合,掩盖表位,阻碍超声处理,增加背景信号
- (3)在显微镜下比较样品前后变化,检查细胞裂解的效率
- (4)首次操作需根据样品优化片段化条件
- (5)无论选择何种消化方法,确保染色质长度处于实验方法的理想范围内
(6)可以联合使用超声处理和核酸酶消化
2. 免疫沉淀 捕获并分离蛋白-DNA复物。
抗体的选择是ChIP-seq实验成功的关键因素。 优先选择ChIP/ChIP-seq级别的抗体。在某些情况下,您的靶标可能尚未经过 ChIP 实验验证。如果抗体经过免疫沉淀 (IP) 验证,则极有可能适用于 ChIP。 其他要求抗体识别天然状态抗原的方法也可以作为参考,例如免疫荧光 (IF),免疫细胞化学 (ICC) 和免疫组织化学 (IHC)。如果针对某些靶标没有可用的抗体,则可以在样品中表达融合亲和标签(HA,Myc,His等)的靶标蛋白,然后使用针对亲和标签的抗体进行免疫沉淀。使用磁珠结合抗体获得抗体-蛋白质-DNA复合物,充分洗涤磁珠-抗体-蛋白质-DNA复合物,纯化并洗脱蛋白质-DNA复合物。
免疫沉淀注意事项:
(1) 并非所有抗体都适用于 ChIP,选择已经验证过的 ChIP 或ChIP-seq 的抗体。
(2) 使用经过应用验证的抗体, IHC 、ICC、IF、 IP是证明抗体是否适合 ChIP 的合理良好佐证。
(3) 抗体浓度做梯度测试,实现最佳的信噪比。
(4) 洗涤液成分和浓度可能影响蛋白结合、信噪比和背景。
(5)可使用抗体同型对照IgG抗体,以便区分 ChIP 信号和背景。
3. DNA制备 解交联和纯化DNA。
含有目标蛋白质的染色质片段已分离,需要解交联并纯化 DNA。 解交联通常采用加热孵育和蛋白酶K消化来完成。为了获得更纯的 DNA 样品,建议使用 RNase A 进行处理。 可使用纯化柱进行 DNA 纯化。
注意: 此时可以暂停ChIP。 经过解交联和纯化后的 DNA 样品可以储存于 -20°C 。
DNA制备注意事项:
4. 定量DNA 检测富集效率。
在该步骤中,通过 qPCR 定量纯化的 DNA 产物,可以确定目标蛋白是否存在于特定位点。 SYBR green 荧光染料是使用最广泛的qPCR 化合物。SYBR green 只有在与双链 DNA (dsDNA) 结合时才发出荧光,荧光强度与 dsDNA 量成正比。 据此您可以定量 DNA 在某些目标区域的富集程度。
(1)检测基因组中预期会富集和缺失的 ChIP 靶标区域。
(2)为这些区域设计引物,确保其扩增效率为 90%—— 105%。
(3)即使之后要做NGS,也应在测序之前执行 qPCR 以确认ChIP实验是否成功。
如果您想了解目标蛋白在整个基因组中的结合位点,那么需要进行NGS建库测序。细胞核内染色质交叠、凝聚,可能会覆盖住大量目标结合位点,导致ChIP富集到的组蛋白结合DNA总量都在ng级别,转录因子往往更少,极大的影响了ChIP-seq建库成功率。根据您ChIP 实验获得的DNA总量可选择相关的建库试剂盒,提高建库成功率。
(1)接头连接后的产物可以用DNA磁珠进行一次纯化,也可以进行两次磁珠纯化筛选一定范围内的DNA片段。
(2)PCR产物出现接头二聚体,可以使用1X磁珠进行两次纯化。
(3)单链建库DNA浓度很低时,可以扩大预变性反应体积。
(4)文库可以使用Qubit定量,微流控制片段分析仪(Qseq或2100)检测DNA片段大小。
上一篇:ATAC-seq
下一篇:蛋白表达纯化