- 首页
- 产品
- 服务
- 现货
- 专题
- 学术
- 关于
上海赛瑞格生物科技有限公司,由一批优秀的中科院博士创建而成,为各类医疗研究机构和医药健康企业提供转化医学研究咨询和技术服务。
上海赛瑞格生物科技有限公司

Western Blot
发布时间: 2022-04-15
浏览量:2608
WB ,Western blot
Western Blot即蛋白质免疫印迹法,也称Western、Western blotting、Western印迹,常简写为WB,是将电泳分离后的细胞或组织总蛋白质从聚丙烯酰胺凝胶转移到固相支持物PVDF或NC膜膜上,然后用特异性抗体检测某特定抗原的一种蛋白质检测技术,现已广泛应用于基因在蛋白水平的表达研究、抗体活性检测和疾病早期诊断等多个方面。上海赛瑞格拥有专业的技术团队,多年的Western Blot试剂研发经验,可以针对客户的不同需要设计不同的实验方案,提供最快捷优质的服务。
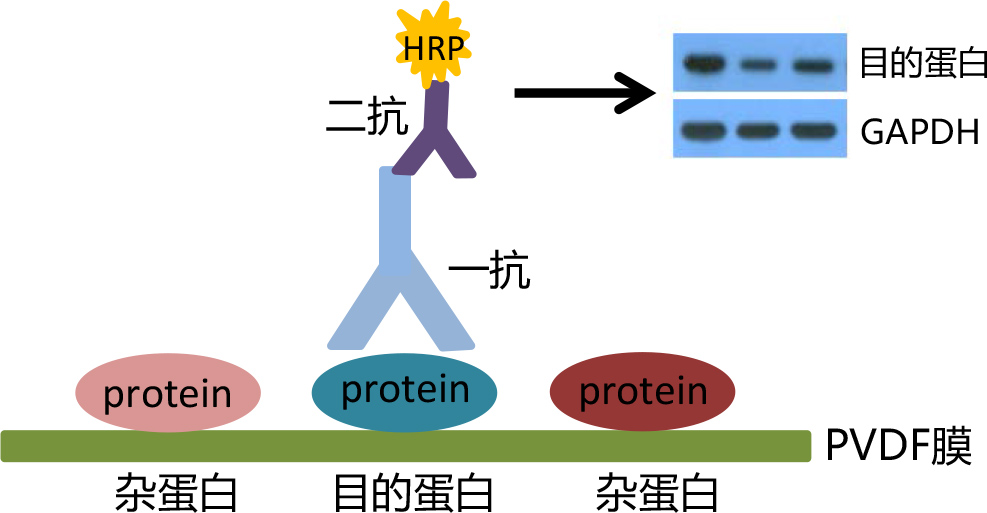
Western Blot基本原理:
Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。经过聚丙烯酰胺凝胶电泳(PAGE)分离的蛋白质样品,通过转膜方式转移到固相载体(如PVDF、NC膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶标记(通常是HRP)的第二抗体起反应,经过底物化学发光试剂(如ECL)发光或显示试剂(如DAB)显色以检测电泳分离的特异性目的基因表达的蛋白成分。
服务承诺
(1)在最短的时间内快速将实验完成。
- (2)根据总蛋白定量的结果,微调各个样本间浓度差异,高温变性,加入loading buffer,上样跑胶,以及转膜显色等步骤。
- (3)利用软件对所得胶片进行扫描,用相对定量方法进行定量分析时,要对管家蛋白等参比蛋白进行同样操作,用所得到的值进行蛋白量的校正,最后求得目的蛋白的相对表达量。
- (4)提供实验报告:包括详细的实验方法及western blot结果的相关图表。
- (5)保证检测结果准确、客观、可信,但不能确保一定要得到某特定结果。
客户提供
- (1)客户须在实验开始前确保其细胞或组织中有目的蛋白的表达,并提供目的蛋白的相关信息(蛋白名称、大小等信息),尽可能详细的背景资料,包括蛋白的种属、大小、参考文献等。
- (2)客户应对所提供的材料及信息负责,如因客户提供的材料及信息不准确而引起的实验延误或经济损失由客户承担。
- (3)新鲜样品(组织为100-150 mg/样,细胞>107 个/样),若为冻存样品,请于-70 ℃以下保存并自备液氮以便运输。一抗,标明来源和稀释度,也可让我司代买。
- (4)WB所需要的目的蛋白的一抗,可自行提供,或在本公司购买相应指标。
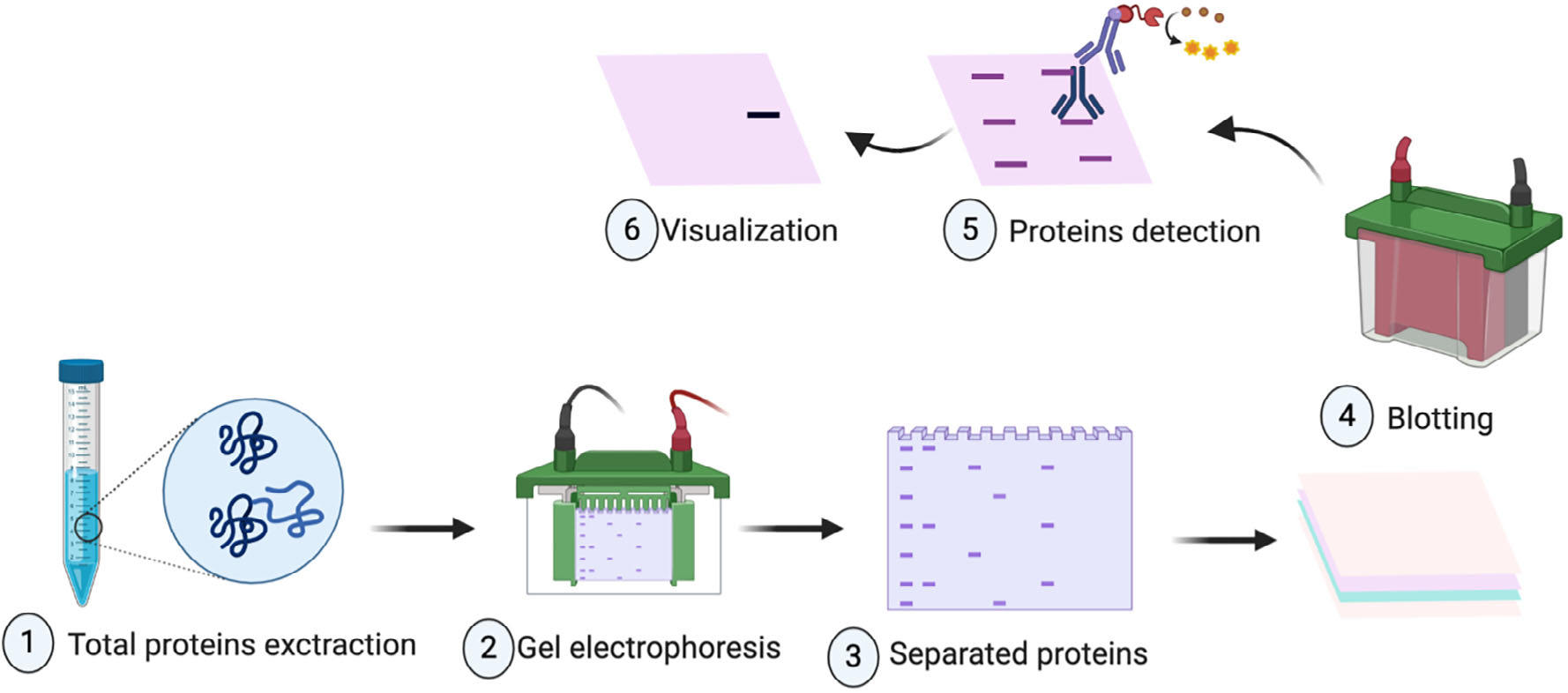
技术路线
蛋白免疫印迹一般由样本处理、凝胶电泳、样品的印迹和免疫学检测组成。
常见问题及解决方案:
| 常见问题 | 可能原因 | 解决方法 |
|---|
| 条带呈笑脸状 | 凝胶不均匀冷却,电泳时中间比两侧更热 | 降低电泳时的电压 |
| 条带呈皱眉状 | 凝胶和玻璃挡板底部有气泡;两边聚合不完全 | 电泳槽中加电泳液时排空玻璃挡板下方的气泡;配胶时充分混匀 |
| 拖尾 | 样本中蛋白溶解不好 | 上样前对样本煮沸5min,离心1min |
| 出现纹理(纵向条纹) | 样本中含有不溶性颗粒 | 上样前对样本煮沸5min,离心1min |
| 条带偏斜 | 电极不平衡或者加样位置偏斜;凝胶不均匀凝固 | 在未加样孔中加入等量样品缓冲液,配胶时充分混匀 |
| 条带弥散 | 上样时样品被电泳缓冲液稀释;浓缩胶配制出错或梳齿底部过短 | 上样时自底部往上缓缓加样;使用新配制AP,按照配方配浓缩胶;梳齿底部至分离胶顶约1.0~1.5cm |
| 条带宽窄不均 | 蛋白浓度不同,上样时体积差异过大 | 浓度高的样本中补充1*上样缓冲液至各样本体积大致相同 |
| 没有阳性条带 | 一抗或二抗失效 | 更换抗体,选择现配现用工作液 |
| 一抗/二抗不匹配 | 更改为同种属及同亚型的抗体底物 |
| 发光液失效 | 更换新的发光液 |
| 标本中不含目的蛋白或目的蛋白含量太低 | 设置阳性对照,确定样本中是否含靶蛋白;增加标本上样量解决靶蛋白含量低 |
| 抗体染色不充分 | 增加抗体浓度;延长孵育时间 |
| 溶液中有辣根过氧化酶抑制剂 | 所有溶液和器皿中避免含有叠氮化钠 |
| 抗体活性降低 | 选择在有效期内的抗体;工作液现配现用,避免长时间放置 |
| 有阳性条带,但条带比较弱 | 样本中目的蛋白含量太低 | 增加标本上样量 |
| 洗膜过度 | 缩短洗涤时间 |
| 曝光时间过短 | 延长曝光时间 |
| 封闭过度 | 减少封闭剂的量或缩短时间;换用不同封闭剂类型 |
| 蛋白转移不充分 | 优化转膜条件;调整转膜时间;严格按照配方配制转膜液体;如为PVDF膜,需提前用100%甲醛浸泡 |
| 背景高 | 洗膜不充分 | 增加洗液体积和洗涤次数;洗涤液中加入Tween-20 |
| 二抗浓度过高 | 降低二抗浓度 |
| 二抗的非特异性背景 | 不加一抗,其他操作过程不变,即可验证背景是否由二抗系统来源;重新选择二抗 |
| 封闭不充分 | 增加封闭液孵育时间,或者提高温度。选择合适的封闭试剂 |
| 抗体与封闭蛋白有交叉反应 | 更换封闭剂;洗涤液中加入Tween-20可减少交叉反应 |
曝光过度
检测过程中膜干燥 | 缩短曝光时间
保证充分的反应液,避免出现干膜现象 |
| 非特异性条带(多条带) | 抗体浓度过高 | 降低抗体(一抗、二抗)浓度 |
| 一抗的特异性不够 | 使用单克隆或者亲和纯化的抗体,保证抗体的特异性 |
| 二抗的非特异性结合 | 不加一抗,其他操作过程不变,即可验证背景是否由二抗系统来源;重新选择二抗 |
| 蛋白上样量过大 | 降低上样量 |
| 蛋白降解 | 避免反复冻融;使用新鲜制备的标本,并使用蛋白酶抑制剂 |
| 不同剪切体存在 | 分析不同剪切体的大小并核对 |
| 细胞传代过多,导致蛋白变异 | 使用原代或传代少的细胞作对照 |
| 背景有不均匀白色斑点 | 转膜过程中有气泡存在 | 仔细检查,避免存在气泡 |
| 抗体分布不均匀 | 孵育抗体时使用摇床 |
上一篇:CRISPR Cas9基因编辑细胞系
下一篇:质谱鉴定